
骆驼优配门店
过去十年,细胞治疗完成了从概念验证到临床成功的关键跨越,到现在,行业正在进入一个新的阶段:从“能不能做”,走向“能否规模化、可重复、可监管”。
1月22–23日,第九届细胞免疫疗法及体内CAR-T论坛将在上海召开。论坛聚焦产业格局与技术突破,深入探讨体内CAR-T、多靶点治疗、自免疾病和实体瘤领域的最新进展,分析从研发到临床的转化路径及全球市场布局,剖析产业化的挑战与机遇。
从Ex Vivo 到 In Vivo:CAR-T逐步发生了范式转移
体内CAR-T正在成为解决传统CAR-T可及性、成本与制造复杂度的重要突破口。
相比 ex vivo CAR-T,in vivo CAR-T尝试绕开复杂的体外细胞操作流程,直接在体内完成免疫细胞重编程。这一方向快速升温的同时,也带来了新的技术挑战:
递送系统如何实现细胞或器官靶向性
RNA/DNA载体如何兼顾效率与安全性
CAR表达是否可控、可逆、非整合
从临床前模型到IND的可转化性
本次会议中围绕RNA递送、病毒与非病毒载体、cirRNA/ non-integrated CAR设计的多场报告骆驼优配门店,正是对这些核心问题的集中回应。
全球I期/IIT In Vivo CAR管线
(近岸蛋白整理,如有错漏,欢迎指正)
免疫细胞疗法不止CAR-T:治疗对象在不断拓展
1月23日的分论坛自免与实体瘤领域的治疗新突破,从议程可以看到几个非常清晰的信号:
NK、TIL、Treg等细胞类型被频繁提及
关注点从“杀伤能力”转向“免疫调控与耐受重塑”
自免疾病、CNS疾病、妇科肿瘤等复杂适应症进入核心讨论
意味着,细胞治疗正在从“单一武器”进化为一套可组合、可调控的免疫工具箱。
由北京大学肿瘤医院主导的一项随机对照试验显示,传统CAR-T对晚期胃癌等实体瘤患者的总体生存期和无进展生存期均显著优于标准治疗,表明细胞治疗已开始奏效于固体瘤领域。表明,传统细胞治疗正在突破血液肿瘤的“禁区”,并与体内路线形成交叉拓展空间[1]。
方法学创新与体系化建设
体内CAR-T的研究已不仅限于少数个案,最新最新发表在 Experimental Hematology & Oncology的综述系统总结了体内CAR-T的研究进展,指出通过病毒载体与纳米颗粒等递送平台实现体内CAR编码递送,有望突破传统ex vivo制备的复杂流程,并结合基因编辑与信号增强策略提升CAR-T治疗效能[2]。
在靶向递送与表达控制方面,还有研究系统总结了体内纳米工程化T细胞体内CAR-T策略,为分子设计提供指导性框架。该综述发表在Journal of Controlled Release,系统梳理了载体设计、靶向策略(如器官/细胞亚群靶向 LNPs)、以及如何通过表达控制元件提升体内CAR-T功能的核心技术路线[3]。
这些方法学上的突破,正在为未来细胞治疗的可控性与精准性建立更扎实的技术基础。
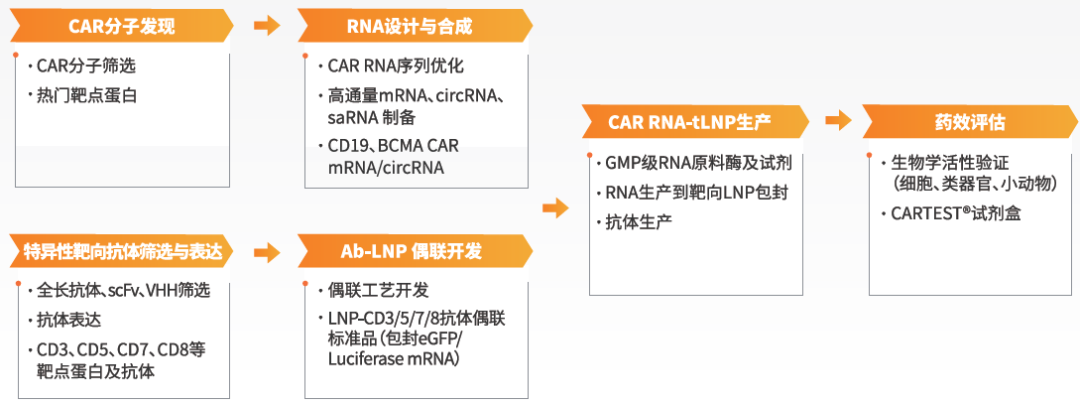
然而无论是体内还是体外疗法,都隐含着一个共性问题:细胞治疗已经不再是“某一个分子或某一项技术”的单一进化,而是整体研发体系的协同。从CAR靶点筛选,到递送策略选择;从RNA/病毒载体构建,到GMP级生产;从体外功能验证,到体内药效与安全性评估。每一个环节,都会直接影响项目能否真正走向临床。
近岸蛋白:以“全流程支撑者”的角色参与行业演进
围绕细胞治疗,近岸蛋白已逐步形成了覆盖:
随着in vivo CAR-T和细胞治疗从理念走向临床转化,越来越强调平台级底层能力的稳定性与可扩展性。围绕这一趋势,近岸蛋白致力于构建覆盖全流程的解决方案:
围绕当前热度不断攀升的in vivo CAR疗法,近岸蛋白整合了从CAR分子发现到靶向递送工艺的全流程研发解决方案:
易倍策略提示:文章来自网络,不代表本站观点。